专业知识
还以为ALK融合检测是肺癌的“专属”吗,NO!消化道肿瘤也要关注
2022-10-10 13:25:14
在肺癌领域中ALK融合/重排的名气非常大,被称为“钻石突变”,ALK抑制剂(ALKi)用于ALK融合阳性非小细胞肺癌的治疗效果取得了显著的进展。随着NGS技术的普及,全面的基因分析必然会发现更多与治疗潜在相关的靶点,ALK融合已被证实为其他多种肿瘤发生的驱动基因。以消化道肿瘤(GI)为例,虽然发生频率较低(不同研究显示结直肠癌0.1-2%),但ALK 抑制剂仍为重要潜在的治疗策略,尤其是对于已经标准治疗用尽的患者,仍秉持着“哪怕有一丝希望,也不要放弃”的信念。接下来我们看看“ALK抑制剂异病同治”这一丝希望是否能再次点亮晚期消化道癌症患者的生命之光?
消化道肿瘤国际队列研究
一项GI患者的国际数据集[1]纳入了经治的转移或不可切除的原发胃肠道癌症患者的临床和分子信息,这些患者均检测过ALK重排,用过至少一种 ALKi 治疗。可测量病灶的患者基于RECIST 1.1标准评估对药物的治疗反应。原发肿瘤部位分布如下:胰腺 5 例(38%),右结肠 3 例(23%),胃、十二指肠、直肠、左结肠和胆道部位各 1 例(8%)。7 例患者 (54%) 接受阿来替尼治疗,5 例患者 (38%) 接受克唑替尼治疗,1 例患者 (8%) 接受恩曲替尼治疗。在 ALKi 一线治疗疾病进展(PD) 后,5 例患者 (38%) 接受了后线 ALKi 治疗线:2 名患者在克唑替尼之后接受阿来替尼, 2 名患者和 1 名患者在阿来替尼治疗失败后分别接受劳拉替尼和色瑞替尼。在数据截止时,两例患者仍在接受二线治疗。
12 例可评估患者中有 5 例 (41%) 在一线 ALKi 治疗后达到部分缓解(PR),5 例 (41%) 疾病稳定,DCR 为 82%,另外2 例 (17%) 患者在第一次评估时为PD。在接受二线 ALKi 治疗的 5 例患者中,2 例患者 (40%) 的最佳反应达到 PR,而 3 例 (60%) 达到 SD。数据截止时,1例PR和1例SD患者仍在继续治疗。(图1)
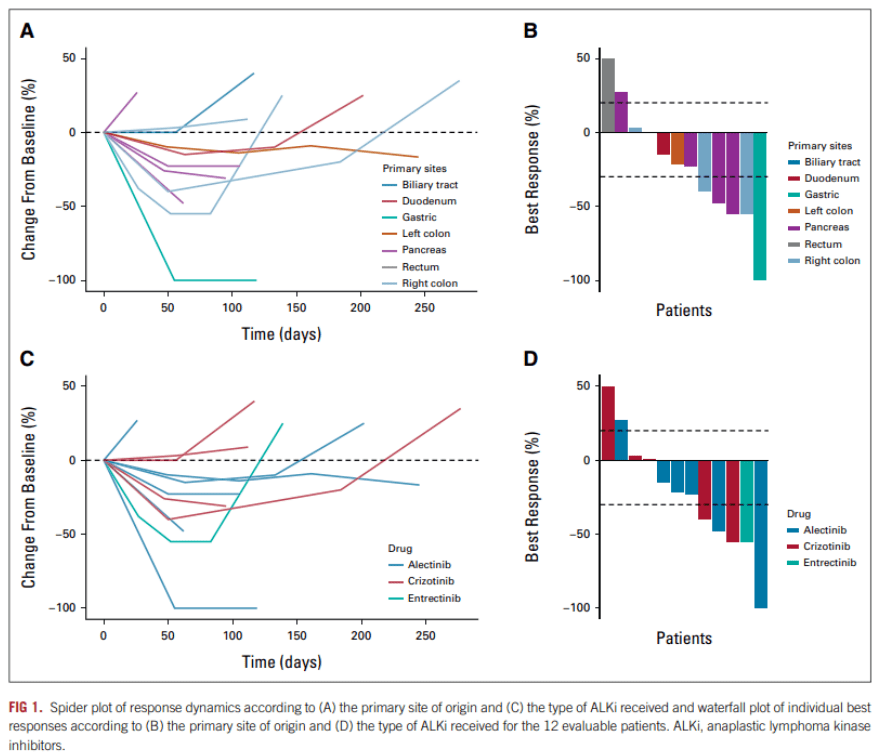 图1
图1
中位随访 39.6 个月(四分位范围:19.8-59.5 个月)。在数据截止时,所有患者都经历了一线 ALKi 治疗后的PD或死亡,其中 11 例(85%)患者死亡。中位 PFS 为 5.0 个月,中位 OS 为 9.3 个月(图 2)。
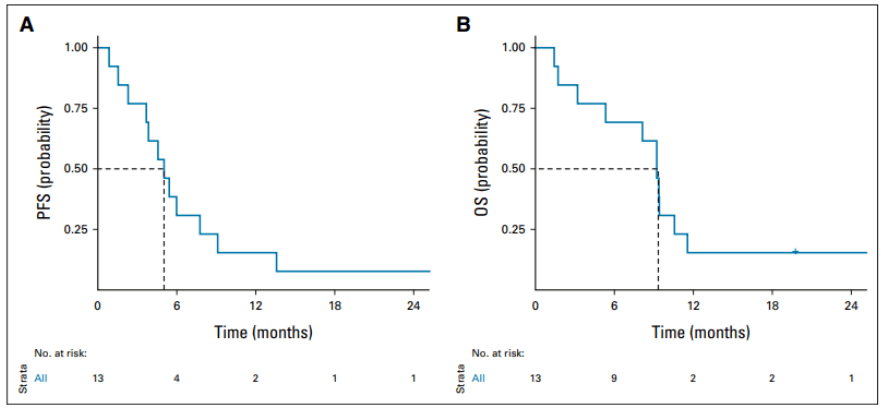 图2
图2
详细阐述这项研究中的一例接受阿来替尼和劳拉替尼治疗的ALK融合阳性晚期胃癌患者的病例(图3):一例局部晚期胃腺癌的 51 岁女性患者接受了围手术期 FLOT 方案。全胃切除术后的组织学检查显示低分化胃腺癌,接近 CR(分期ypT0N1)。免疫组化分析显示 CDX2局部阳性染色,PAX8、TTF1 阴性,HER2 (1+) ,错配修复蛋白表达。不幸的是观察到纵隔淋巴结早期复发。
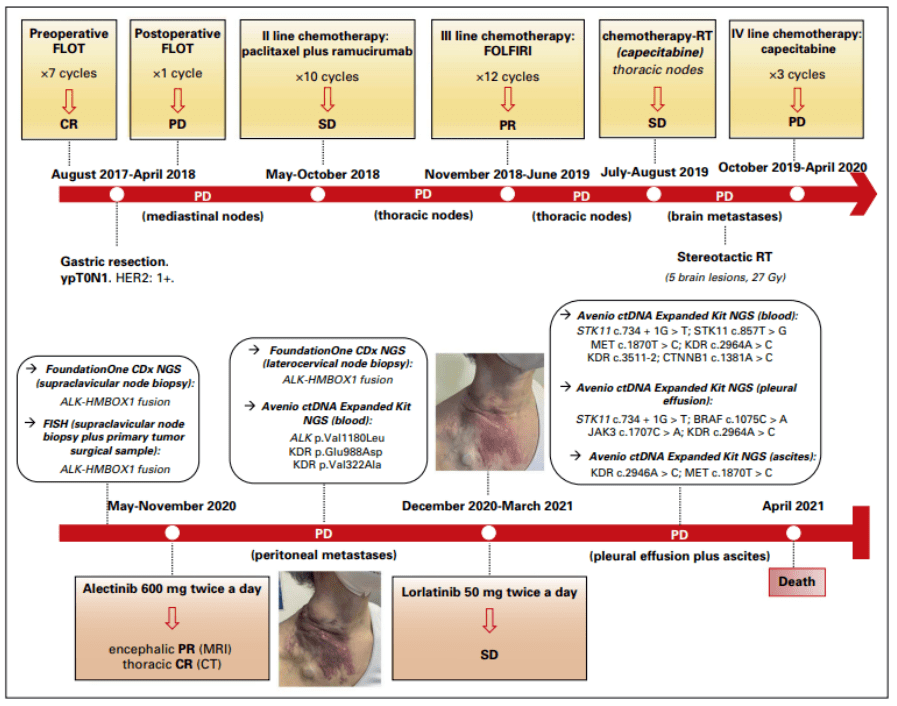 图3、患者临床病史和连续分子检测时间表
图3、患者临床病史和连续分子检测时间表
患者接受了紫杉醇/雷莫芦单抗和氟尿嘧啶、亚叶酸和伊立替康的治疗,随后对纵隔淋巴结进行了以卡培他滨为基础的放化疗,并对有症状的脑转移进行立体定向放疗。对 PD 部位的颈侧淋巴结活检后进行NGS检测发现ALK-HMBOX融合基因,并通过FISH方法得到验证。该患者于 2020 年 5 月开始每天两次 600 mg 阿来替尼,ECOG体能状态为 3,主要是因为出现了有症状的脑转移。用药后产生了快速且显著的症状改善:几周后,神经系统症状几乎完全消失,ECOG体能状态为 1。2020 年 7 月进行影像学评估显示胸部和颈部病灶 CR和脑部病灶PR。由于腹部 PD,于 2020 年 10 月中断阿来替尼。对来自 PD 的颈部淋巴结组织二次NGS检测,表明仍携带ALK-HMBOX融合,没有获得性耐药突变。使用液体活检NGS panel检测发现一种 ALKi 耐药突变:p.Val1180Leu(突变丰度 0.19%)。患者于 2020 年 12 月开始使用二线劳拉替尼 50 mg,每天 2 次,临床症状进一步得到改善和影像学SD,直至 2021 年 3 月。患者病情发生恶化(腹膜疾病、腹水和胸腔积液),通过液体活检NGS再次分析发现之前检测到的携带ALK Val1180Leu点突变的克隆细胞群已经被劳拉替尼消除。然而检测到了另一种新的耐药机制-STK11内含子功能缺失突变(c.734+1G>T),在胸腔积液和血浆的突变丰度分别为 5.95% 和 0.72%。患者最终因 PD 于 2021 年 4 月去世。劳拉替尼耐药时出现的STK11突变是否可采取靶向mTOR 通路的抑制呢?还需要进一步的探索。
病例报道
小编又查找了过往发表的一些病例报道[2]均证实了在CRC 患者中应用ALK 抑制剂可取得一定的临床获益。(图4)
 图4
图4
我们详细了解一下近期发表的几个病例情况。海军军医大学长征医院在2021发表了一篇关于ALK 基因重排转移性结直肠癌患者对克唑替尼、阿来替尼和劳拉替尼的临床治疗反应的病例报道[3]。一位 70 岁女性患者确诊为中至低分化结直肠腺癌,肠镜活检样本进行NGS大panel检测发现EML4- ALK融合(E21;A20)、TP53 R157H、AKT1等基因突变,通过抗ALK[D5F3]抗体IHC验证为ALK表达。患者先后接受了一周的XELOX治疗、9天的FOLFOX6治疗均因各种临床症状原因终止。由于EML4- ALK融合的存在,患者于 2019 年 7 月 10 日接受了口服克唑替尼(250 mg,每天两次)治疗后肿瘤相关腹痛消失。一个月后,CT显示腹膜后淋巴结肿大和肝转移的部分缓解 (PR)并伴随血清 CEA 和 CA 19-9 降低。治疗四个月后出现软脑膜转移 (LM)症状,伴有血清CA 19-9持续升高。脑部 MRI 显示脑沟弥漫性线状强化。第二次血液ctDNA NGS检测,除了发现EML4 - ALK融合(0.3%)和TP53突变(0.3%)的突变丰度较低外,未发现耐药突变。患者接受阿来替尼(600mg,每天两次)治疗,LM症状略有缓解,但2周后并未完全消失。因此,从 2019 年 12 月 9 日开始,采用五线三代酪氨酸激酶抑制剂劳拉替尼,剂量为 75 mg qd。随着患者的 LM 症状逐渐改善,药物剂量增加到 100 mg qd。劳拉替尼的PFS为 11.5 个月。由于血清 CEA 和 CA 19-9 增加以及稳定的颅外病变,患者于 2020 年 8 月 13 日进行脑脊液和血浆样本的第三次 ctDNA 检测。令人惊讶是在脑脊液中EML4- ALK突变丰度达到99%,并且伴有其他基因变异,例如FGFR2突变,KRAS扩增和PTEN缺失(图5)。
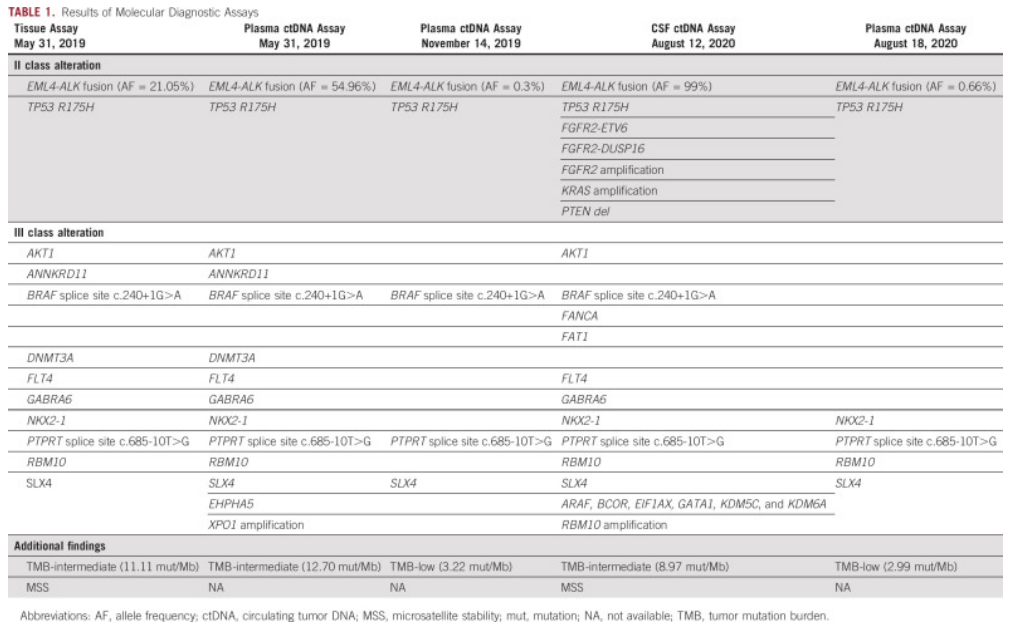 图5
图5
由于没有证据表明出现与ALK变异相关的进展,因此劳拉替尼仍在使用。患者因 LM 进展于 2020 年 9 月 17 日去世。总之,该病例报道了一名接受克唑替尼、阿来替尼和劳拉替尼治疗的ALK融合 mCRC 老年患者, 达到PR的PFS 分别为 3、0.5 和 11.5 个月。(图6)
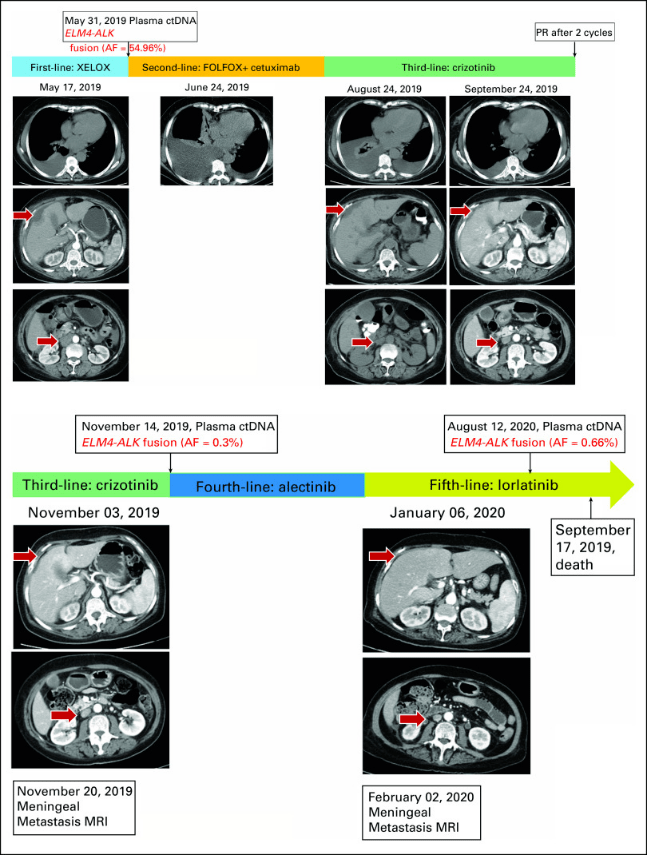 图6、mCRC 患者的治疗方案和血浆NGS ctDNA的监测结果
图6、mCRC 患者的治疗方案和血浆NGS ctDNA的监测结果
台湾奇美医学中心在2021年也报道了一篇case[2],一例56 岁的男性确诊为IV 期结肠癌,KRAS、NRAS 和 BRAF 基因均为野生。错配修复蛋白表达,HER2未表达。该患者接受了帕尼单抗联合 FOLFOX 方案的治疗。然而,部分反应仅维持了 3 个月后,肝和肺转移进展。随后,治疗方案改为 FOLFOXIRI 联合贝伐单抗,但疾病仍进展。由于患者对晚期 CRC 的标准治疗反应不佳,于是结肠镜活检进行了NGS 大panel的检测,检测到EML4-ALK融合及其他非靶向突变。患者接受阿来替尼治疗一个月后,CEA 显著下降,临床症状随着腹水减少而减轻。重复 CT 扫描显示符合RECIST 1.1 标准的部分缓解,肺转移和肝转移灶缩小。临床和生化改善持续 8 个月,随后疾病进一步进展。随后,再次取腹水和外周血进行NGS 大panel检测。腹水测序结果显示 EML4-ALK 融合、KRAS 扩增和 TP53 剪接突变 (738-2A>G)。由于肿瘤纯度低,无法确定微卫星状态和肿瘤突变负荷。外周血测序结果也检测到 EML4-ALK 融合,还有KRAS Q61H 、NF1 Q20 和 TP53 剪接突变 (783-2A>G) 。在这两个测序结果中都没有报告其他 ALK 突变。(图33)。由于在不同组织血类型和疾病的不同时间点均检测到 ALK 融合基因(图7),于是患者尝试转用色瑞替尼治疗 3 个月。尽管 CEA 水平暂时下降,但转移性病灶仍进展。又改为布加替尼单药治疗,患者最终在结肠癌诊断后 22 个月死于肝功能衰竭。作者解释后续的ALK 抑制剂并未阻止该疾病进展,可能是出现新的耐药突变,需要引入更有效的 ALK 抑制剂,如劳拉替尼。另一种可能的原因是,疾病进展后使用ctDNA检测KRAS Q61H表明胃肠癌的肿瘤异质性或为获得性耐药机制,应考虑标准治疗方案,例如瑞戈非尼或曲氟尿苷替匹嘧啶(LONSURF)。这是第一篇关于携带 EML4-ALK 融合基因的升结肠腺癌患者接受阿来替尼单药治疗 8 个月,然后依次使用色瑞替尼和布加替尼治疗的综合病例报告。因此,对晚期结直肠癌患者进行ALK基因检测具有重要意义和必要性。
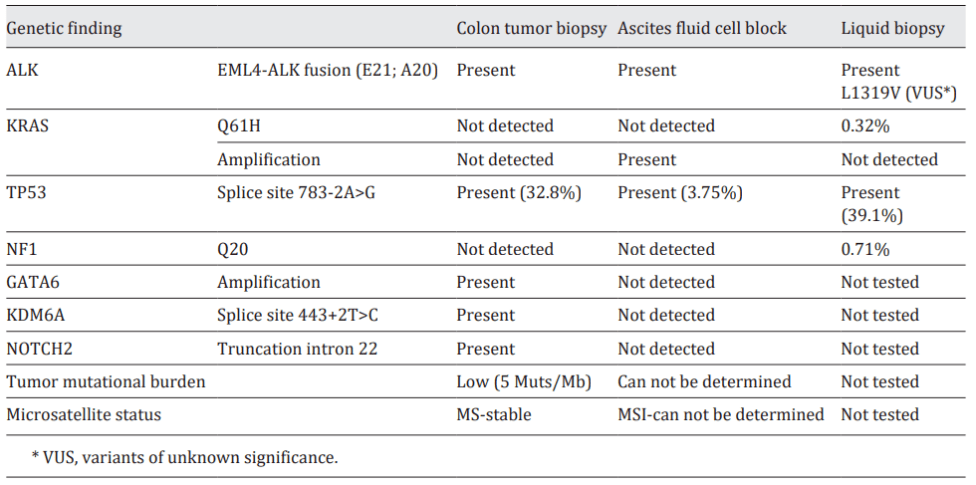 图7、该患者不同组织类型的二代测序结果
图7、该患者不同组织类型的二代测序结果
尽管 NSCLC 以外的实体瘤患者中ALK融合/重排的发生率较低,但多项循证医学证据已经表明对于治疗选择有限的晚期癌症患者进行全面的分子检测仍然至关重要,检测到 ALK 融合阳性可能为这些胃肠道癌患者带来一次或多次延续生命的机会。


